Goud
Goud is een scheikundig element met symbool Au (aurum) en atoomnummer 79. Het is een geel metalliek overgangsmetaal. Het is al sinds de stroomculturen (Nabije Oosten van 3500 v.Chr. tot 800 v.Chr.) zeer gewaardeerd. Het kan niet oxideren, daarom wordt goud soms "de koning der metalen" genoemd.
Eigenschappen
Goud behoort tot de edelmetalen en is een zeer zwaar en zacht metaal, net iets harder dan zink. Voordat het gebruikt kan worden, moet het gezuiverd worden. Voor de meeste doeleinden wordt het gelegeerd met andere materialen, om het harder te maken, maar ook om de kleur te beïnvloeden. Het massagehalte aan goud van sieraden wordt gemeten in karaat; zuiver goud is 24 karaat. Veel voorkomende zuiverheidsgraden in Nederland zijn 14 karaat (58,3% goud), 18 karaat (75%) en 22 karaat (91,7%).
Goud wordt al lange tijd als waardevol metaal gezien. In Egyptische hiërogliefen van de 26e eeuw v.Chr. wordt al melding gemaakt van goud als betaalmiddel. Tot ongeveer halverwege de 20e eeuw n.Chr. werd goud nog veelvuldig gebruikt voor munten.
In de oudheid was goud niet alleen bekend als waardevol, er ging ook magie van uit en stond symbool voor zuiverheid. Alchemisten zijn lange tijd op zoek geweest naar de steen der wijzen, om andere materialen te transformeren in goud. Dat zij daar nooit in zijn geslaagd, is vanuit de huidige inzichten over de opbouw van atomen goed te verklaren.
In de 19e eeuw zijn er vooral in de Verenigde Staten en Australië veel nieuwe, rijke goudvoorkomens ontdekt, hetgeen leidde tot goldrushes. Bekende voorbeelden zijn de Californische goldrush en de Goldrush van Klondike.
Het symbool van goud Au is de afkorting van het Latijnse aurum. De naam goud is afgeleid van de Indo-europese wortel ĝhel- waarvan ook geel afkomstig is.[1]
Opmerkelijke eigenschappen



Puur metallisch goud heeft een gele, glanzende kleur. Er zijn honderden mogelijke legeringen en mengsels. Witgoud is een legering van goud en ten minste één wit metaal, zoals zilver, mangaan of palladium. Door toevoeging van koper ontstaat rose of rood goud. Goud kan worden gelegeerd in verschillende kleuren. Zo bestaat er groen goud, zwart goud, grijs goud, paars goud en blauw goud. Deze kleuren worden in het algemeen verkregen door het legeren van goud met andere elementen in verschillende verhoudingen.
Van alle bekende metalen die bij kamertemperatuur vast zijn, is goud, na lood, het gemakkelijkst te buigen en te vervormen. Een blokje goud van 1 gram (een kubusje met zijden van 3,73 mm) kan worden geplet en gewalst (zie metaalbewerking) tot een folie van bladgoud met een oppervlakte van 1 vierkante meter. Bladgoud kan gelijmd worden op voorwerpen om ze te vergulden. Het is ook mogelijk een voorwerp te vergulden door middel van elektrolyse.
Goud is een zeer goede elektrische en thermische geleider en is vrijwel inert. De dichtheid van goud (19.320 kg/m3) is bijna tweemaal zo groot als die van lood (11.300 kg/m3).
Goudchemie
Goud staat bekend als een inert edelmetaal dat weinig reactiviteit vertoont; het reageert bijvoorbeeld niet met zuurstof. Toch zijn er redelijk wat goudverbindingen bekend zoals goudhalogeniden en goudchalcogeniden. Het metaal is oplosbaar in koningswater waarbij het een AuCl4−-ion vormt. Met zwaardere elementen, zoals telluur, is de reactiviteit zelfs vrij groot.
Goud vormt in de regel verbindingen met een oxidatiegetal +1 of +3. Er is echter ook een klein aantal verbindingen waarin het zelf als oxidator optreedt en oxidatiegetal −1 aanneemt, de auriden.
Calaveriet (goudtelluride) is een mineraal en gouderts.
Verschijning
Door de relatieve inertheid komt goud veelal in ongebonden vorm in de natuur voor. Meestal komt het voor als sporenelement in mineralen, maar soms ook in de vorm van goudnuggets (goudklompjes)[2], en ook weleens in de vorm van een grote goudklomp. De grootste goudklomp die ooit is gevonden, is de Welcome Stranger Nugget met een gewicht van ruim 71 kilo. Deze werd in 1869 gevonden in Moliagul, Victoria, Australië op bijna een meter diepte, en is omgesmolten. De Serra Pelada (Canaã) Nugget werd gevonden in 1983 in de buurt van Serra Pelada, Pará, Brazilië. Met een gewicht van ruim 61 kilo is deze de grootste, nog in zijn oorspronkelijke vorm bestaande, goudklomp.[3]
In vrijwel de gehele aardkorst komt goud in zeer lage concentraties voor, in de mineralen petziet, calaveriet en sylvaniet. De hoeveelheden zijn echter voor commerciële winning volstrekt onrendabel.
De hoogste concentraties worden sinds 1880 gevonden in Zuid-Afrika. Andere grote goudmijnen bevinden zich in Nevada en South Dakota in de Verenigde Staten. In de jaren 20 van de twintigste eeuw werden enorme goudvoorraden ontdekt in de regio Kolyma, in het verre oosten van Siberië. Omdat de exploratie ervan van groot strategisch belang werd geacht voor de ontwikkeling van de jonge Sovjet-Unie, werden de vondsten geheim gehouden - er werd tevens uranium gevonden - en werd het gebied tot begin jaren 90 onder bewind van de geheime dienst van de Sovjet-Unie geplaatst.
Bij de belangrijkste goudproducerende landen horen (in 2001) ook Australië, Indonesië en Volksrepubliek China. Recycling van oud goud levert een kwart tot een derde van het totale aanbod. De jaarproductie uit de mijnen lag in de jaren 2010 tot en met 2017 tussen de 2745 en 3270 ton, ofwel ten minste twee derde van het totale aanbod.
| Topproducenten van goud 2019[4] | |
|---|---|
| Land | Productie (ton) |
| 380 | |
| 325 | |
| 305 | |
| 200 | |
| 175 | |
| 142 | |
| 139 | |
| 128 | |
| 111 | |
| 107 | |
| 105 | |
| 90 | |
Ongeveer twee derde van de winning vindt in open mijnen (dagbouw) plaats en geeft grote hoeveelheden afval. Door de winning van het goud voor een ring van 10 gram met een gehalte van 18 karaat ontstaat 18.000 kg afval.
Een goudwinningsmethode gebruikt het giftige natriumcyanide door het goud eerst op te lossen volgens:
- <chem>4 Au + 8 NaCN + O2 + 2 H2O -> 4 Na[Au(CN)2] + 4 NaOH </chem>,
vervolgens wordt het met zink gereduceerd:
- <chem>2Na[Au(CN)2] + Zn -> Na2[Zn(CN)4] + 2Au</chem>.
Het giftige natriumcyanide heeft onder andere een grote milieuramp veroorzaakt bij de Summitville mijn in Rio Grande County, Colorado in de Verenigde Staten.
De andere methode gebruikt het eveneens giftige kwik, omdat goud daarin oplost (goud-kwik amalgaam). In Suriname wordt deze methode van goudwinning nog steeds toegepast.
Gewoonlijk komt goud voor als fijne korrels, verspreid in een gesteente. Om zichtbaar te zijn voor het blote oog moet de verhouding goud in gouderts meer dan 30 mg/kg (30 ppm) bedragen. Voor de meeste goudmijnen betekent dit dat het goud in het erts niet zichtbaar is.
Ontstaan
Goud is al aanwezig op Aarde sinds het ontstaan van de planeet zelf, maar het is niet gevormd op Aarde omdat voor de productie ervan fusiereacties nodig zijn. Er vinden kernfusiereacties plaats in de kern van sterren, maar deze kernfusiereacties voorzien niet in genoeg energie voor de productie van goud. Sterren die zwaar genoeg zijn (vanaf ongeveer 8 keer de massa van de Zon) beëindigen hun leven in een supernova-explosie. Tijdens deze explosie worden er door middel van kernreacties zware metalen gevormd, waaronder goud.[5] Na de explosie worden stofdeeltjes met daarin minuscule beetjes goud de ruimte in geslingerd. Wanneer de stofdeeltjes in het zwaartekrachtveld van een ster zoals de Zon komen, zullen de stofdeeltjes onderdeel worden van de samenklonterende materie rond de ster en uiteindelijk planeten vormen.
Isotopen
| Stabielste isotopen | |||||
|---|---|---|---|---|---|
| Iso | RA (%) | Halveringstijd | VV | VE (MeV) | VP |
| 195Au | syn | 168,10 d | EV | 1,220 | 195Pt |
| 197Au | 100 | stabiel met 118 neutronen | |||
Er zijn één stabiele isotoop van goud bekend en ongeveer 18 instabiele, waarvan 195Au met een halveringstijd van ruim 168 dagen het stabielst is.
Toxicologie en veiligheid
Voor het menselijk lichaam is zuiver goud onschadelijk. De meeste goudverbindingen zijn niet bijzonder giftig. Beschadigingen van lever en nieren, dermatitis en colitis, kunnen echter ontstaan bij relatief hoge doses goudverbindingen (in de orde van grootte van wekelijks enkele tienden van een gram, zoals nodig bij de behandeling van reumatoïde artritis) soms met dodelijke afloop.[6] Soms wordt beweerd dat colloïdaal goud kan worden opgenomen door zogenaamde macrofagen, witte bloedcellen die een belangrijke rol spelen bij het op gang houden van een ontstekingsproces (zoals bij RA), waarna deze worden gedood (en de ontsteking wordt geremd). Hiertoe wordt dit goud veelal geïnjecteerd in patiënten (omdat hoge doses nodig zijn voor effect). Het werkelijke effect van colloïdaal goud op mensen is echter nooit goed onderzocht.[7]
Het menselijk lichaam (bij een gewicht van 70 kg) bevat van nature ca. 0,2 mg goud.[8]
Toepassingen
Sinds de 20e eeuw is goud praktisch onmisbaar. Enkele toepassingen zijn:
- Kwalitatief hoogwaardige elektrische schakelaars en connectoren.
- In de ruimtevaart als coating voor kunstmanen – maar ook voor toepassingen op aarde – omdat goud infrarode straling goed reflecteert.[9]
- Vanwege de hoge dichtheid, als gewicht in een zelfopwindend horloge, in de hogere prijsklasse.[10]
- In veel elektronische componenten wordt goud gebruikt.
- De radioactieve isotoop 195Au wordt gebruikt bij kankeronderzoek.
- Kronen in de tandheelkunde.
- Hoewel het veelal is vervangen door andere metalen wordt in sommige monetaire stelsels goud (nog) gebruikt voor muntgeld.
- Als dekking van papiergeld (zilver wordt daarbij ook gebruikt).
- De mooie glans en de goede corrosiebestendigheid maken goud een gewild metaal voor sieraden.
- Goud is vanwege zijn glans en schaarsheid een symbool van weelde. Huishoudelijke voorwerpen werden dan ook soms van goud gemaakt of verguld. Hetzelfde gold voor kunstwerken.
- Borduurwerk (brokaat) met gouddraad, eigenlijk slagmetaal.
Kunst- en gebruiksvoorwerpen zoals klokken en kandelaars werden in het verleden verguld door dampen[bron?] van in kwik opgelost goud (amalgaam) op het voorwerp te blazen, waarbij het kwik verdampte en het goud in een dunne laag neersloeg. Dit is niet meer toegestaan door de ernstige giftigheid van deze dampen.[bron?]
Ongeveer de helft van het goud wordt verwerkt in juwelen; slechts 10% heeft een industriële bestemming. Als zuiver metaal is goud vrijwel onbruikbaar voor industriële toepassingen, omdat het erg zacht is. In plaats daarvan wordt het veelvuldig gebruikt in legeringen, omdat het element over uitstekende elektrische eigenschappen beschikt en zeer goed bestand is tegen corrosie.
Goud als belegging
Veel beleggers gebruiken goud als een belegging. Ongeveer een derde van het goud wordt jaarlijks hiervoor opzijgelegd. De centrale banken kopen jaarlijks ongeveer een tiende van het goudaanbod op en bergen dit op in hun kluizen. India en de Volksrepubliek China zijn de grootste kopers van goud.
Omdat goud als waardevast beschouwd wordt, stijgt de vraag naar goud wanneer de economie in een crisis verkeert en andere beleggingen als riskant worden gezien. Hierdoor stijgt de goudprijs in tijden van economische onzekerheid. Men zegt in de financiële wereld ook wel dat 'goud van instabiliteit houdt'. Wanneer de economie verbetert, verkopen beleggers hun goud weer, om terug te keren naar andere investeringen die een beter rendement bieden en waarvan het risico weer binnen de perken is; de goudprijs daalt dan weer. Er bestaat dan ook een goudcyclus die tegengesteld aan de economische conjunctuur verloopt.
Gouden standaard
Een wereldwijde gouden standaard bestond tot 1971 in de vorm van het systeem van Bretton Woods, waarin de Amerikaanse dollar inwisselbaar was voor goud tegen een vaste prijs, en de valuta van de overige landen een vaste wisselkoers ten opzichte van de dollar hadden. De zogenoemde Nixon-schok, een serie economische maatregelen van de Amerikaanse president Richard Nixon, maakte aan dit systeem een eind.
Consumptie van goud
Er zijn verschillende dranken waarin goud verwerkt is. Dit betreft 24-karaats bladgoud.
- goudlikeur:
- sake: Kimpun Sake
- wijn: Luxor champagne
- Ook zijn er bonbons te koop, waarin bladgoud is verwerkt.[11][12] In sommige restaurants wordt bladgoud aan gerechten zoals desserts toegevoegd.
- Als kleurstof voor voedingsmiddelen is goud bekend onder het E-nummer E175.
Prijsontwikkeling

Tot medio 1971 speelde goud een cruciale rol in het internationale financiële systeem. De waarden van de valuta waren direct of indirect in goud uitgedrukt en de centrale bankiers bepaalden de prijs van het goud. De prijs van goud was decennia lang heel stabiel. In de naoorlogse wereld stond dit bekend als het systeem van Bretton Woods, naar de plaats waar dit werd afgesproken. De Amerikaanse president Richard Nixon maakte hieraan op 15 augustus 1971 een einde, zijn maatregel staat nog bekend als de Nixon-schok. Na de Nixon-schok is de prijs van goud een kwestie van vraag en aanbod. Op de internationale goederenmarkten wordt de goudprijs uitgedrukt in Amerikaanse dollars per troy ounce, dat is iets meer dan 31,1 gram. In 1980 bereikte de goudprijs een record van 887 dollar per troy ounce. In 2011 bereikte de goudprijs een nieuw nominaal record van 1900 dollar per troy ounce, gecorrigeerd voor inflatie was dit nog altijd iets lager dan het oude record. Met de invasie en oorlog in Oekraïne door het Russische leger bereikte goud de hoogste prijs ooit van 1938 dollar per troy ounce op 30 maart 2022.
Sinds de top in 1980 heeft het goud in een zogenoemde ‘bear market’ gezeten. Na de grote inflatie van eind jaren zeventig en begin jaren tachtig steeg de prijs van goud naar een recordhoogte van US$ 887 per ounce. Hierna daalde de goudprijs naar een dieptepunt van US$ 254 per ounce in 2001, om vervolgens aan een ongekende klim te beginnen. Deze klim is te danken aan het feit dat wereldwijd duidelijk werd bij de grote investeerders en economen dat de Verenigde Staten zich diep in de schulden aan het steken waren en deze financierden via hun eigen valuta via de Federal Reserve (FED). Deze toevlucht naar fysiek goud is versterkt door de eurocrisis. Beleggingsgoud wordt geleverd in munten, zoals de krugerrand, of in baarvorm. Tegenwoordig kan men ook in Gold exchange-traded funds (GETF) beleggen.
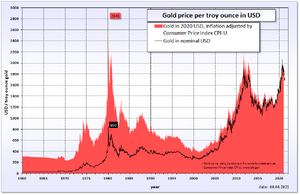
| Jaar[13] | Gemiddeld | Mutatie |
|---|---|---|
| 1970 | 35,9 | - |
| 1975 | 161,0 | 348% |
| 1980 | 612,6 | 280% |
| 1985 | 217,3 | −65% |
| 1990 | 383,5 | 76% |
| 1995 | 384,2 | 0% |
| 2000 | 279,1 | −27% |
| 2005 | 444,7 | 59% |
| 2010 | 1224,5 | 175% |
| 2011 | 1571,5 | 28% |
| 2012 | 1669,0 | 6% |
| 2013 | 1411,2 | −15% |
| 2014 | 1266,4 | −10% |
| 2015 | 1160,1 | −8% |
| 2016 | 1250,7 | 8% |
| 2017 | 1257,1 | 1% |
| 2018 | 1268,5 | 1% |
| 2019 | 1392,6 | 10% |
| 2020 | 1769,6 | 27% |
| 2021 | 1798,6 | 2% |
Taal

Het stoffelijk bijvoeglijk naamwoord van goud is gouden. Het oudere gulden wordt soms ook nog gehoord. Bedekt men iets met een laagje goud of goudverf, dan heet dat vergulden. Het woord goud heeft in het taalgebruik zijn plaats veroverd als "waardevol" en/of "duurzaam", of wordt anders figuurlijk gebruikt, bijvoorbeeld:
- Een gouden bruiloft staat voor een 50-jarige huwelijksverjaardag
- Een gouden jubileum staat voor een 50-jarig jubileum
- De gouden medaille staat symbool voor de eerste plaats
- De gouden plaat, voor veelverkochte muziekalbums
- De Gouden Eeuw
- De gulden snede
- Het Gulden Vlies
- De valuta gulden, oorspronkelijk een gouden munt.
Etymologie
De naam goud stamt via Oudhoogduits, Oudfries en Angelsaksisch gold, Gotisch gulþ, Krimgotisch goltz af van protogermaans *gulþ-a "goud". Het woord duidt in feite het geelglanzende metaal aan. Op zijn beurt afstammend van Indo-Europese wortel *ĝhel "geelglanzend".[14]
Klatergoud, kattengoud, goudglimmer
Het woord klatergoud betekent iets dat men voor goud of iets waardevols wil laten doorgaan maar het feitelijk niet is. Een voorbeeld daarvan is het mineraal pyriet (vgl. Engels: fool's gold, Duits: narrengold), dat door zijn goudachtige uiterlijk geliefd was bij pseudoalchemisten en kwakzalvers. Ook kattengoud is nepgoud — katten staan bekend als vals —, alleen verwijst dit naar geel mica of, gewestelijk, naar gele hars. Geel mica staat ook bekend onder de naam goudglimmer.[15]
De term goud in biologische benamingen
Het woord goud wordt ook in de biologie gebruikt om dieren en planten een naam te geven. De naam 'gouden' kan zowel slaan op een gele kleur als op een goudachtige glans; vaak wordt het Latijnse aurata gebruikt. Voorbeelden zijn de plant goudenregen (Laburnum anagyroides), de gouden pijlgifkikker (Dendrobates auratus) en de gouden tor (Cetonia aurata) vanwege de metallieke glans.
Zie ook
Externe links
- Lenntech.nl - goud
- (Engels) EnvironmentalChemistry.com - goud
- (Engels) WebElements.com - goud
- (Engels) World Gold Council, een economische website over goud
- ↑ Etymologiebank
- ↑ https://www.perthnow.com.au/news/wa/pilbara-gold-rush-wa-man-who-found-gold-strikes-deal-of-a-lifetime-ng-711d10e05d715d67e2798b5ac0f68991. Gearchiveerd op 24 september 2022.
- ↑ Gearchiveerde kopie. Gearchiveerd op 11 juli 2018. Geraadpleegd op 11 juli 2018.
- ↑ USGS
- ↑ (Engels) Harvard–Smithsonian Center for Astrophysics,Earth's Gold Came from Colliding Dead Stars, Woensdag 17 juli 2013. Gearchiveerd op 4 oktober 2013.
- ↑ (Engels) O. Andersen (1999). Principles and Recent Developments in Chelation Treatment of Metal Intoxication. Chemical Reviews 99 (9): 2683–2710 (American Chemical Society). DOI: 10.1021/cr980453a. Geraadpleegd op 28 maart 2011.
- ↑ (de) Bernd Kerschner, Kolloidales Gold: fragwürdiges „Heilmittel“ zum Trinken. Medizin Transparent. Gearchiveerd op 13 april 2020. Geraadpleegd op 13 april 2020.
- ↑ (Engels) Periodic Table of Elements. Element Gold - Au. Environmental Chemistry. Geraadpleegd op 28 maart 2011.
- ↑ Ruimtevaart in ons dagelijks leven. Gearchiveerd op 26 januari 2023.
- ↑ Patek Philippe
- ↑ Goldleaf Chocolate. 23 karaat goud en chocolade. Linders Bonbons. Gearchiveerd op 4 juni 2013. Geraadpleegd op 22 juli 2011.
- ↑ (Engels) Chocolate gift with edible gold. DeLafée. Gearchiveerd op 4 augustus 2011. Geraadpleegd op 22 juli 2011.
- ↑ (Engels) Statista Average gold price in U.S. Dollar per troy ounce, geraadpleegd op 10 juli 2022. Gearchiveerd op 1 juli 2022.
- ↑ J. de Vries, F. de Tollenaere (1983). Etymologisch woordenboek. Waar komen onze woorden vandaan?, 13e druk. Het Spectrum.
- ↑ Kattengoud. INL (1922). Gearchiveerd op 8 november 2011. Geraadpleegd op 4 september 2011.
Digitalisering en Wiki opmaak: Terry van Erp
